국내 제약바이오업체들이 개발하고 있는 파이프라인들의 가시적인 성과들이 잇따라 발표될 것으로 전망되고 있어 투자자들로부터 관심을 모으고 있다. 파이프라인들의 가시적인 성과발표는 주가에 큰영향을 미치고 있기 때문이다.
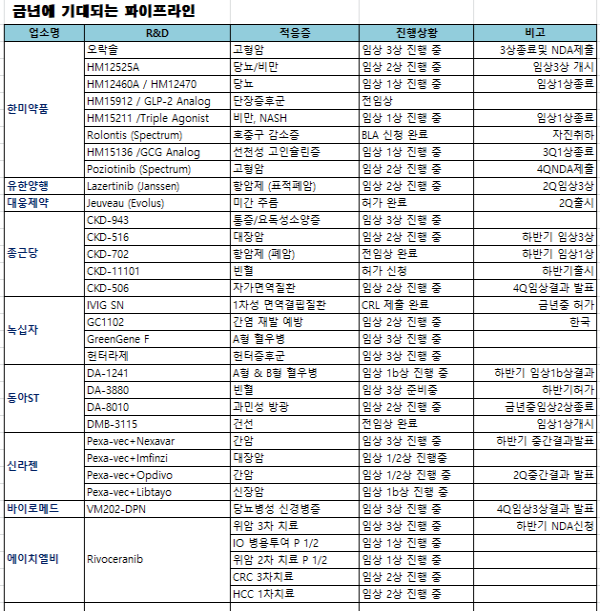
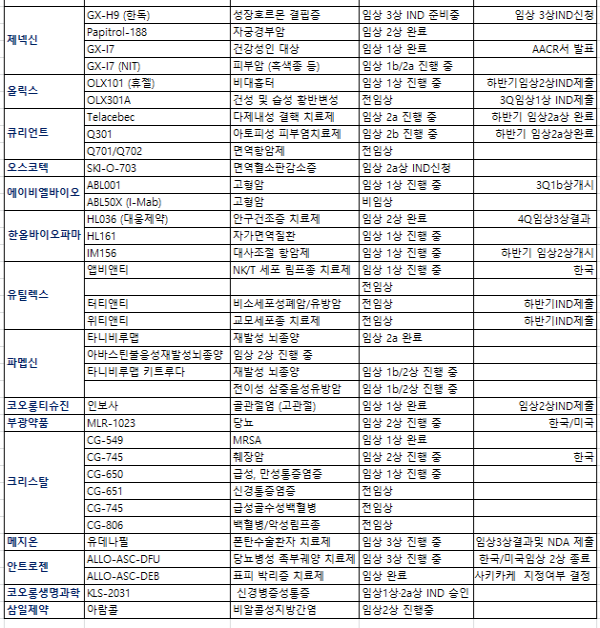
국내 제약바이오기업들이 금년에 기대되고 있는 파이프라인들중에서 임상3상과 IND제출 또는 FDA허가등 15개에 이르고 있는 것으로 타나났다.
또한 전임상을 거쳐 임상 1상에 진입하고나 임상2상·임상3상 진입하는 파이프라인들도 잇따를 것으로 전망되고 있어 기업가치를 제고하는데 큰 역할을 할 것으로 분석된다.
실제로 국내 최초로 미국 FDA로부터 허가를 획득한 대웅제약의 나보타는 미국 출시가 초읽기에 들어갔으며 중국 시장 진출에도 속도를 내고 있다. 나보타의 마케팅 파트너인 Evolus는 지난 2월 FDA의 품목 승인 발표 이후 금년 봄 나보타를 출시할 것이라고 발표했다. 이에 따라 대웅제약은 올해 4월부터 나보타의 미국 물량 선적을 시작할 계획이다. 또 중국 식품의약품관리총국(CFDA)에 접수한 나보타의 임상시험신청(CTA)에 대한 제조시설 변경이 지난 6일 최종 승인, 나보타에 대한 임상 3상을 본격적으로 진행할 예정이다.
GC녹십자의 IVIG-SN은 이르면 상반기 내 2차 보완 서류가 제출될 것이며 서류 제출 후 2~6개월의 시간이 소요되는 것을 감안해 연내 승인될 것으로 예상된다. A형 혈우병 치료제 그린진F, 헌터증후군 치료제 헌터라제는 임상 3상이 진행중이며 조만간 허가신청이 예상되고 있다.
올해 가장 많은 가치 변화가 예상되는 기업은 한미약품이다. 한미약품의 보유 파이프라인의 임상 1상 종료가 3건, 임상 2상 종료가 2건, 임상 3상 종료가 1건 예정되어 있다. 이중 가장 빠른 개발 단계를 밟고 있는 파이프라인은 롤론티스로 연내 허가가 기대된다. 경구용 항암제인 Oraxol은 임상 3상 환자 모집이 완료되어 결과를 해석하는 일만 남았다. 한미약품 파트너사인 스펙트럼은 15일 미국 FDA에 제출한 롤론티스의 BLA(생물의약품 허가신청)를 자진 취하했지만 데이터 등을 신속히 보완하고 2~3개월쯤 뒤 BLA를 재신청할 계획이다.
미국 바이오벤처 기업인 카라쎄라퓨틱스와 종근당이 공동개발 중인 수술 후 통증 관리 및 요독성 소양증 치료제 CKD-943은 현재 임상 3상이 진행중이며 네스프 바이오시밀러 CKD-11101은 일본에서 판매 승인을 신청하고 허가를 기다리고 있으며 하반기에 출시될 것으로 전망된다.
세계 최초로 개발 중인 바이로메드의 당뇨병성 신경병증 치료제 VM202-DPN은 임상3상을 진행하고 있으며 올해 4분기께 임상 결과를 발표할 계획이다.
한독과 제넥신이 개발하고 있는 지속형 성장호르몬제 GX-H9은 올해 하반기에 미국 임상3상 진행을 위한 임상시험 계획 승인신청(IND)을 제출 계획이고 메지온의 폰탄수술환자 치료제를 개발 중인 유데나필은 2분기에 임상3상 시험 결과가 발표, 올 3분기에 허가를 신청하고 내년 상반기 출시가 예상된다.
에이치엘비의 리보세라닙은 위암(3차 치료제) 적응증을 대상으로 글로벌 임상 3상 중이며 7월 임상 3상을 종료할 예정이며 리보세라닙+PD-1 병용임상 글로벌 임상 3상 진입이 기대된다.
  |
| <자료제공:KB증권> |
김사랑 기자 kimsarang0420
'주식' 카테고리의 다른 글
| "미국서도 돌풍 조짐"…휠라코리아, 시총 4兆 돌파 (0) | 2019.03.22 |
|---|---|
| 바이로메드 IR 경과보고 (1) | 2019.03.20 |
| [클릭 e종목]"올릭스, 기술이전은 이제 시작" (0) | 2019.03.19 |
| [단독]신라젠, 리제네론과 신장암 이어 간암 병용 추진 (0) | 2019.03.18 |
| [특징주] 텔콘RF제약, 오피란제린 FDA 추가 전임상 완료…임상 3상 임박‘↑’ (0) | 2019.03.14 |
